KONDISI STABIL ATOM UNSUR
G.N.
Lewis dan W. Kossel, di tahun 1916 menjelaskan kecenderungan atom-atom unsur di
alam untuk bergabung dengan atom-atom unsur lainnya melalui ikatan kimia membentuk
unsur atau senyawa. Menurut mereka atom unsur berikatan dengan atom unsur lainnya
dalam upaya untuk mendapatkan konfigurasi elektron yang stabil seperti yang
dimiliki gas mulia.Untuk memahami hal ini, lihat tabel berikut ini
Unsur
gas mulia
|
Nomor
atom, Z
|
Jumlah
elektron pada kulit atom
|
Konfigurasi
elektron
|
|||||
K
|
L
|
M
|
N
|
O
|
P
|
|||
He
|
2
|
2
|
2
|
|||||
Ne
|
10
|
2
|
8
|
2.8
|
||||
Ar
|
18
|
2
|
8
|
8
|
2.8.8
|
|||
Kr
|
36
|
2
|
8
|
18
|
8
|
2.8.18.8
|
||
Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
2.8.18.18.8
|
|
Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
2.8.18.32.18.8
|
Dari
konfigurasielektron gas mulia di atas:
·
Unsur-unsur gas mulia yang sangat stabil,
kecuali He, memiliki 8 elektron valensi.
Dengan demikian, unsur-unsur lain berusaha memperoleh konfigurasi elektron seperti
gas mulia untuk mencapai kestabilan. Hal inidirumuskan dengan Aturan
Oktet:
Atom-atom
cenderung memiliki konfigurasi elektron padakulit terluarnya seperti konfigurasi
elektron gas mulia terdekat dengan atom-atom tersebut
·
Unsur gas mulia He memiliki 2 elektron valensi.
Unsur-unsur dengan nomor atom kecil, yakni H dan Li berusaha memiliki konfigurasi
elektron gas mulia terdekat, yaitu memiliki 2 elektron valensi seperti He untuk
mencapai kestabilan. Hal ini dirumuskan menjadi Aturan Duplet
IKATAN
ION
Ikatan ion terbentuk akibat kecenderungan
atom-atom menerima atau melepas elektron agar memiliki konfigurasi elektron seperti
gas mulia terdekat. Ikatan ion umumnya terbentuk antara atom-atom unsur logam dan
non-logam. Hal ini terkait kecenderungan atom unsur logam untuk melepas elektron
membentuk ion positif, dan kecenderungan atom unsur non-logam untuk menerima
elektron membentuk ion negatif.
Contoh ikatan ion yaitu NaCl.
- Atom
Na (Z = 11) merupakan atom logam. Konfigurasi elektronnya (2.8.1). gas mulia
yang memiliki konfigurasi elektron terdekat dengan Na adalah Ne (2.8). jadi Na
akan melepas 1 elektron membentuk atom Na bermuatan +1, yang disebut ion Na+.
- Atom
Cl (Z = 17) merupakan atom non-logam. Konfigurasi elektronnya (2.87). gas mulia
yang memiliki konfigurasi terdekat dengan Cl adalah Ar (2.8.8). jadi atom Cl akan
menerima 1 elektron membentuk atom Cl bermuatan -1, yang disebut ion Cl-
1. Lambang
Lewis
Serah terima elektron dalam ikatan
ion dapat digambarkan dengan menggunakan lambang Lewis. Lambang Lewis dari suatu
unsur dinyatakan oleh lambang unsur dikelilingi oleh sejumlah tanda titik (•)
atau tanda silang (x). tanda tersebut menyatakan jumlah elektron valensi dari unsur
tersebut.
Penggunaan
lambang Lewis untuk menggambarkan ikatan ion dapat di simak pada contoh berikut.
Gambar
1.Lambang Lewis padapembentukanikatan ion dalamsenyawaNaCl
Penggunaan
tanda yang berbeda untuk elektron (• dan x) untuk membedakan asal elektron valensi.
Namun, pada dasarnya, kita tidak dapat membedakan asal suatu elektron dalam ikatan
kimia.
Contoh:
Gunakan
lambang Lewis untuk menggambakan pembentukan ikatan ion antara Ca (Z = 20) dan
atom F (Z = 9) dalam senyawa kalsium fluoride (CaF2).
Jawab;
- Atom
Ca (Z = 20) memiliki konfigurasi elektron (2.8.8.2). Gas mulia yang memiliki konfigurasi
terdekat dengan atom Ca adalah Ar (2.8.8). Jadi, atom Ca akan melepaskan 2
elektron membentuk ion Ca2+.
- Atom
F (Z = 9) memiliki konfigurasi elektron (2.7). gas mulia yang memiliki konfigurasi
elektron terdekat dengan atom F adalah Ne (2.8). jadi, atom F akan menerima 1
elektron membentuk ion F-.
2. Pengecualian
Aturan Oktet untuk ikatan ion
Aturan ikatan oktet untuk ikatan ion hanya berlaku untuk unsur-unsur
logam golongan IA dan IIA, serta unsur-unsur non-logam. Akan tetapi, aturan oktet tidak dapat ditetapkan untuk:
- Unsur-unsur
logam transisi. Sebagai contoh, logam Fe dapat membentuk ion Fe2+ dan
Fe3+. Konfigurasi elektron kedua ion tersebut tidak sama dengan konfigurasi
elektron gas mulia terdekat dengan Fe
- Unsur-unsur
logam setelah golongan transisi. Sebagai contoh, logam Sn dapat membentuk ion
Sn2+ dan Sn4+. Konfigurasi elektron kedua ion tersebut tidak
sama dengan gas mulia terdekat dengan logam Sn.
IKATAN KOVALEN
Ikatan
kovalen terbentuk akibat kecenderungan atom-atom untuk menggunakan elektron bersama
agar memiliki konfigurasi elektron seperti gas mulia terdekat. Atom-atom yang berikatan
secara kovalen umumnya adalah atom-atom non-logam. Contohnya ikatan kovalen
yang terbentuk antara dua atom non-logam Cl pada gas klorin Cl2.
Atom
Cl (Z = 17) memiliki konfigurasi elektron (2.8.7). gas mulia yang memiliki konfigurasi
elektron terdekat adalah Ar (2.8.8). sewaktu atom Cl bergabung dengan atom Cl lainnya, transfer elektron tidak mungkin terjadi.
Hal ini dikarenakan kemampuan kedua inti atom Cl untuk menarik elektron adalah sama.
Meski demikian, masing-masing atom Cl dapat menggunakan 1 elektron valensinya membentuk
sepasang elektron yang dapat digunakan bersama. Dengan demikian, kedua atom Cl dapat
memenuhi aturan oktet. Sebagai akibat dari penggunaan bersama pasangan elektron
oleh dua atom disebut ikatan kovalen.
Gabungan
atom-atom melalui ikatan kovalen dinamakan molekul.
§ jika
atom-atom tersebut berasal dari unsur sejenis, maka molekul tersebut dinamakan molekul
unsur, contoh: Cl2, O2, P4 dan S8.
§ jika
atom-atom tersebut berasal dari unsur-unsur berbeda jenis, maka molekul tersebut
dinamakan molekul
senyawa, contohnya H2SO4,
HCl, CO2, CH4.
1. Struktur
Lewis
Seperti penjelasan sebelumnya, struktur
Lewis menggambarkan jenis-jenis atom
dalam
molekul atau bagaimana atom-atom tersebut terikat satu sama lain. Untuk jelasnya
simak struktur Lewis dari Cl2.
Dari struktur Lewis diatas, terlihat adanya sejumlah pasangan elektron. Pasangan elektron dapat dibedakan menjadi 2 yakni :
§
Pasangan
elektron ikatan (PEI) adalah pasangan elektron yang digunakan bersama
§
Pasangan
elektron bebas (PEB) adalah pasangan elektron yang tidak digunakan bersama
2. Jenisikatankovalen
Berdasarkan jumlah pasangan elektron
yang digunakan bersama (pasangan elektron ikatan), ikatan kovalen yang
terbentuk antara 2 atom unsur dapat berupa ikatan kovalen tunggal dan ikatan kovalen
rangkap.
§ Ikatan
kovalen tunggal (–)
Ikatan kovalen tunggal melibatkan penggunaan
bersama 1 pasangan elektron oleh dua atom yang berikatan.Dengan kata lain,
hanya terdapat 1 pasangan elektron ikatan. Simak struktur Lewis dari H2O
berikut
§ Ikatan
kovalen rangkap
Ikatan kovalen rangkap adalah ikatan kovalen
yang melibatkan penggunaan bersama 2 atau lebih pasangan elektron ikatan oleh dua
atom yang berikatan. Kita mengenal ikatan rangkap dua dan ikatan rangkap tiga.
i.
Ikatan kovalen rangkap dua (=)
Ikatan rangkap dua terbentuk
jika terjadi penggunaan bersama 2
pasangan elektron oleh dua atom yang berikatan. Dengan kata lain, terdapat dua
pasang elektron berikatan. Untuk jelasnya, simak struktur Lewis dari O2 berikut.
ii.
Ikatan kovalen rangkap tiga
Ikatan rangkap tiga terbentuk
jika terjadi penggunaan bersama tiga pasangan elektron oleh dua atom yang
berikatan. Dengan kata lain, terdapat tiga pasangan elektron ikatan. Untuk jelasnya
simak struktur Lewis dari molekul N2.
Pengecualian
Aturan Oktet untuk Ikatan Kovalen
Aturan oktet untuk ikatan kovalen mempunyai
beberapa pengecualian. Hal ini dikarenakan atom-atom dalam suatu molekul dapat memiliki
jumlah elektron pada kulit terluarnya kurang atau lebih dari 8. Simak beberapa contoh
berikut:
IKATAN KOVALEN KOORDINASI
Ikatan kovalen koordinasi adalah ikatan kovalen dimana
elektron-elektron dalam pasangan elektron yang digunakan bersama berasal dari
salah satu atom yang berikatan.
Sebagai contoh, perhatikan molekul NH3
berikut, yang tersusun dati 1 atom N dan 3 atom H. Setiap atom H menggunakan
bersama satu elektronnya dengan satu elektron dari atom N. Dengan demikian,
terbentuk 3 ikatan kovalen disekeliling atom pusat N sesuai aturan oktet.
Gambar 5. Ikatan kovalen pada molekul NH3.
Kalian
mungkin akan beranggapan bahwa atom N tidak akan dapat membentuk ikatan kimia
lagi karena sudah memiliki 8 elektron (oktet) pada kulit terluar. Akan tetapi,
sewaktu molekul NH3 dimasukkan kedalam larutan asam (mengandung ion H+),
ternyata atom pusat N dapat mengikat ion H+ membentuk ion NH4+.
Penjelasannya adalah sebagai berikut:
Ikatan antara atom N da ion H+ dalam ion NH4+ dapat terbentuk karena ion H+ mempunyai tempat kosong pada kulit elektronnya. Ion H+ dapat menampung 2 elektron untuk mencapai konfogurasi elektron gas mulia (aturan duplet). Disisi lain, atom N mempunyai 1 pasangan elektron bebas. Atom N dapat bertindak sebagai atom donor dengan menggunakan pasangan elektronnya bersama dengan ion H+. Jenis ikatan seperti inilah yang disebut ikatan kovalen koordinasi.
Ikatan antara atom N da ion H+ dalam ion NH4+ dapat terbentuk karena ion H+ mempunyai tempat kosong pada kulit elektronnya. Ion H+ dapat menampung 2 elektron untuk mencapai konfogurasi elektron gas mulia (aturan duplet). Disisi lain, atom N mempunyai 1 pasangan elektron bebas. Atom N dapat bertindak sebagai atom donor dengan menggunakan pasangan elektronnya bersama dengan ion H+. Jenis ikatan seperti inilah yang disebut ikatan kovalen koordinasi.
Contoh
lain ikatan kovalen koordinasi adalah pada molekul CO.
Untuk lebih memahami, simak video berikut

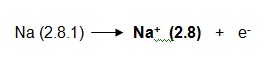














Materi Ikatan Kimia 1 ini sangat bermanfaat. Terima kasih.
BalasHapus